昨日(3月31日),商務(wù)部、海關(guān)總署、國家藥品監(jiān)督管理局聯(lián)合發(fā)布了《關(guān)于有序開展醫(yī)療物資出口的公告》(以下簡稱《公告》)。
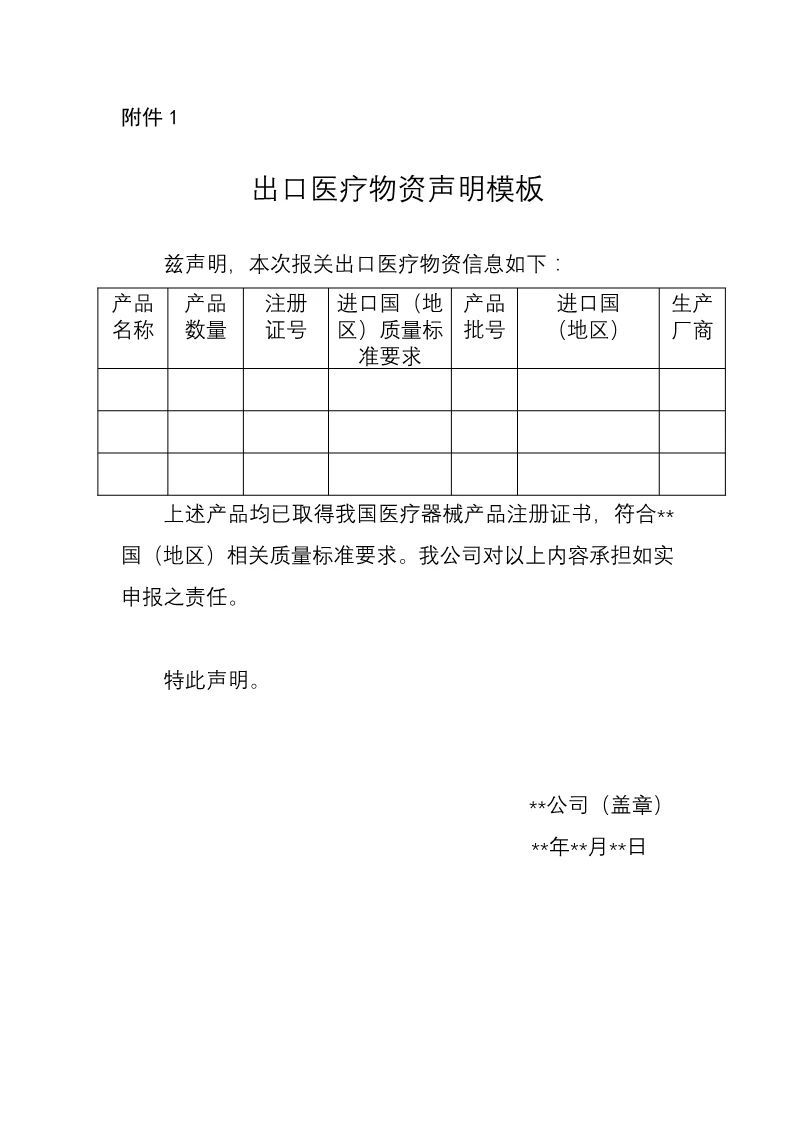
《公告》中明確,自4月1日起,出口新型冠狀病毒檢測試劑、醫(yī)用口罩、醫(yī)用防護(hù)服、呼吸機(jī)、紅外體溫計的企業(yè)向海關(guān)報關(guān)時,須提供書面或電子聲明(模版見附件1),承諾出口產(chǎn)品已取得我國醫(yī)療器械產(chǎn)品注冊證書(相關(guān)注冊信息見附件2),符合進(jìn)口國(地區(qū))的質(zhì)量標(biāo)準(zhǔn)要求。
海關(guān)憑藥品監(jiān)督管理部門批準(zhǔn)的醫(yī)療器械產(chǎn)品注冊證書驗放。上述醫(yī)療物資出口質(zhì)量監(jiān)管措施將視疫情發(fā)展情況動態(tài)調(diào)整。
出口規(guī)則的變動,也就意味著,從今天(4月1日)開始,沒有國內(nèi)注冊證的上述防疫相關(guān)物資將不予出口!
隨著各國疫情的全面爆發(fā),抗疫物質(zhì)全球緊缺,許多國家開始從中國采購防疫物資。各大企業(yè)出口業(yè)務(wù)的增長的同時,隨之帶來的一個問題就是對于產(chǎn)品質(zhì)量的把控。
近期,市面上就出現(xiàn)了由中國出口的新冠病毒檢測試劑靈敏度遭到質(zhì)疑的問題。據(jù)西班牙衛(wèi)生部官方發(fā)文稱,在中國購買的快速檢測試劑盒質(zhì)量不合格,效果遠(yuǎn)不如預(yù)期。
出口海外檢驗試劑不合格問題,一時間引發(fā)了大量的討論,討論中無疑也引起了國家對于出口物資質(zhì)量監(jiān)管的重視。
據(jù)涉事企業(yè)官方回應(yīng)稱,假陰性的出現(xiàn)不排除因驗證時的操作流程、病人病歷、采樣等事項導(dǎo)致結(jié)果偏差的可能,具體原因雙方仍在溝通核實(shí)。
而值得注意的是,這起事件中確實(shí)存在企業(yè)出口檢驗試劑僅有歐盟認(rèn)證,未在國內(nèi)取得注冊證的事實(shí)。
事實(shí)上,我國對于疫情相關(guān)醫(yī)療器械的質(zhì)量要求一直很嚴(yán)格,對于出口的抗疫物資也非常的重視。本次三部委聯(lián)合出臺的出口新規(guī)也是出于對出口抗疫物資質(zhì)量的嚴(yán)格把關(guān),避免再次出現(xiàn)此類爭議事件。
對于正在進(jìn)行出口業(yè)務(wù)的相關(guān)械企而言,目前的首要任務(wù)就是申請國內(nèi)的醫(yī)療器械產(chǎn)品注冊證書,獲得“中國認(rèn)證”。與此同時,這也是對于醫(yī)療器械生產(chǎn)廠家的一個提醒,特殊時期下更要做好產(chǎn)品質(zhì)量的把關(guān)。
此外,需要提醒的是,出口規(guī)則的調(diào)整后,國內(nèi)注冊證的審核標(biāo)準(zhǔn)將更加嚴(yán)格,審核時間或?qū)⒆冮L,械企要及時做好銷售調(diào)整。
目前具備出口資質(zhì)的產(chǎn)品 :新型冠狀病毒檢測試劑23個;醫(yī)用防護(hù)口罩150個、醫(yī)用外科口罩523個、一次性使用醫(yī)用口罩752個;醫(yī)用防護(hù)服301個;呼吸機(jī)62個;紅外體溫計236。
文章來源:醫(yī)療器械經(jīng)銷商聯(lián)盟
